Застосування балонного катетера з покриттям лікарським засобом паклітаксел у терапії de novo уражень дрібних судин і рестенозу коронарних артерій: результати 12-місячного проспективного багатоцентрового непорівняльного випробування PREVAIL
Азім Латіб (Azeem Latib), MD1,2; П’єрфранческо Агостоні (Pierfrancesco Agostoni), MD, PhD3 ; Джо Денс (Jo Dens), MD, PhD4 ; Марк Паттерсон (Mark Patterson), MBBS, PhD5 ; Патріціо Ланцеллотті (Patrizio Lancellotti), MD, PhD6 ; Френкі С.С. Там (Frankie C.C. Tam), MD7 ; Карл Шотборг ( Carl Schotborgh), MD8 ; Елвін Кеді (Elvin Kedhi), MD9 ; Пітер Стелла (Pieter Stella), MD, PhD10; Черил Шен (Cheryl Shen), MS11; Гвенн Ветцелз (Gwenn Wetzels), PhD11; Лука Теста (Luca Testa), MD12; від імені дослідників випробування PREVAIL
Анотація
Цілі. У випробуванні PREVAIL оцінювалися безпека й ефективність черезшкірної транслюмінальної коронарної ангіопластики з використанням балонного катетера, покритого паклітакселом, для лікування de novo уражень коронарних артерій та рестенозу всередині стента (ISR) у пацієнтів із симптомною ішемічною хворобою серця.
Методи. Було проведене проспективне багатоцентрове непорівняльне випробування PREVAIL, в якому взяли участь пацієнти з клінічними ознаками ішемії та ураженнями коронарних артерій (de novo або вперше виявлений ISR), які відповідали критеріям для застосування балонного катетера з покриттям лікарським засобом (DCB). До участі у випробуванні були залучені 50 суб’єктів (53 цільові ураження), яким проводилося індексне втручання з використанням балонного катетера Prevail з покриттям лікарським засобом («Медтронік» (Medtronic)) та за якими був забезпечений подальший нагляд упродовж 12 місяців. Середня протяжність ураження становила 14,5 ± 7,6 мм. Первинною кінцевою точкою був показник пізнього зменшення просвіту (LLL) всередині стента (балона), що визначався за результатами кількісної коронарної ангіографії через 6 місяців після процедури. Якщо через 6 місяців середній показник LLL всередині стента (балона) був менше максимального допустимого рівня, що становив 0,5 мм, випробування вважалося успішним.
Результати. Середній показник (LLL) всередині стента (балона) склав 0,05 ± 0,44 мм через 6 місяців після виконання процедури. Упродовж 12 місяців не спостерігалися випадки смерті, інфаркту міокарда або тромбозу стента (ураження). Частота реваскуляризації цільового ураження за клінічними показаннями становила 6,0% через 12 місяців, а реваскуляризації цільової судини – 10,0%.
Висновки. Використання балонного катетера з покриттям лікарським засобом паклітаксел для терапії de novo уражень коронарних артерій та вперше виявленого рестенозу всередині стента дало змогу зменшити показник LLL через 6 місяців та знизити частоту випадків реваскуляризації й подій, пов’язаних із безпекою, упродовж 12 місяців. Видання «JOURNAL OF INVASIVE CARDIOLOGY» («Журнал інвазивної кардіології»), 19 серпня 2021 р. (публікація до виходу номера).
Ключові слова: DCB, балон з покриттям лікарським засобом, рестеноз всередині стента, ішемія, реваскуляризація.
1-річні результати випробування PREVAIL з використання коронарного DCB
ЛАТІБ та ін. (LATIB, ET.AL.) 2
Як альтернатива стентам, що вивільнюють лікарські засоби (DES), балонні катетери з покриттям лікарським засобом (DCB) забезпечують цільову доставку препарату для запобігання рестенозу під час черезшкірного коронарного втручання (ЧКВ) без імплантації постійного стента. Роль коронарних DCB у лікуванні рестенозу всередині стента (ISR) і уражень дрібних судин оцінювалася у клінічних випробуваннях. Результати проспективних непорівняльних, ретроспективних та обсерваційних когортних досліджень і дані реєстрів свідчать, що DCB з паклітакселом є безпечним й ефективним засобом лікування уражень таких типів.1-6 Хоча рандомізовані контрольовані дослідження продемонстрували, що DCB з паклітакселом є більш ефективними ніж ангіопластика з використанням непокритих балонних катетерів і не поступаються за ефективністю DES при лікуванні ISR в коронарних артеріях, 7-14 були отримані неоднозначні результати щодо пацієнтів з ураженням дрібних судин, що вказує на відсутність клас-специфічного ефекту у цих пристроїв, а також, що не всі DCB мають однакову будову. 15-17
Мета цього дослідження полягала в оцінці клінічної безпеки й ефективності балонного катетера наступного покоління з покриттям паклітаксел для проведення черезшкірної транслюмінальної коронарної ангіопластики (ЧТКА) при лікуванні пацієнтів з ураженнями de novo або ISR. У статті наведені результати ангіографії, зібрані через 6 місяців, а також 12- місячні клінічні дані й показники безпеки.
Методи
Дизайн випробування. PREVAIL – проспективне багатоцентрове непорівняльне передринкове випробування, в якому оцінювалися клінічна безпека й ефективність балонного катетера Prevail з покриттям паклітаксел («Медтронік») для ЧТКА при лікуванні коронарних уражень de novo, ISR та захворювання дрібних судин у пацієнтів із симптомною ішемічною хворобою серця. Пацієнтам виконувалося індексне втручання з використанням DCB і проводилися обстеження в межах подальшого клінічного нагляду через 30 днів, 6 місяців та 12 місяців після процедури. Кількісна коронарна ангіографія (QCA) виконувалася до й після процедури, а також через 6 місяців подальшого нагляду. Усі пацієнти надали інформовану згоду. Комітет з оцінки клінічних явищ провів аналіз та виніс рішення за кожною клінічною кінцевою точкою (Інститут клінічних досліджень Бейма (Baim Institute for Clinical Research)).
Комітет з моніторингу даних здійснював оцінку даних з безпеки впродовж усього випробування (Інститут клінічних досліджень Бейма). Центральна ангіографічна лабораторія провела аналіз знімків, одержаних під час процедури та в період подальшого нагляду (Медичний центр Бет-Ізрейєл Діконісс (Beth Israel Deaconess Medical Center)).
Випробування проводилося з дотриманням вимог Гельсінської декларації, принципів Належної клінічної практики, описаних в ISO 14155:2011, та норм чинних законів, визначених відповідними державними органами. Протокол був переглянутий і затверджений всіма комітетами з етики та наглядовими радами медичних установ. Усі пацієнти надали інформовану згоду в письмовій формі перед залученням до участі у випробуванні. Випробування внесене до реєстру clinicaltrials.gov (NCT03260517).
Популяція пацієнтів. Пацієнти, включені у випробування, мали документально підтверджену стабільну чи нестабільну стенокардію та/або клінічні ознаки ішемії й вважалися прийнятними кандидатами для терапії з використанням DCB. Основними критеріями виключення були попереднє ЧКВ на цільовій судині (впродовж <9 місяців перед індексною процедурою для уражень de novo та <3 місяців для ISR), інсульт/транзиторна ішемічна атака впродовж <6 місяців або інфаркт міокарду (ІМ) за <72 години до індексної процедури. Повний перелік критеріїв включення/виключення викладений у Додатковій таблиці S1. Усім пацієнтам, залученим до участі у випробуванні, виконувалася ангіографія з метою підтвердження додаткових ангіографічних критеріїв включення/виключення згідно з наведеним у Додатковій таблиці S1. Слід зазначити, що необхідними умовами були: протяжність цільового ураження – ≤25 мм, діаметр референтної судини – 2–4 мм та звуження просвіту внаслідок стенозу ≥50%, але <100%.
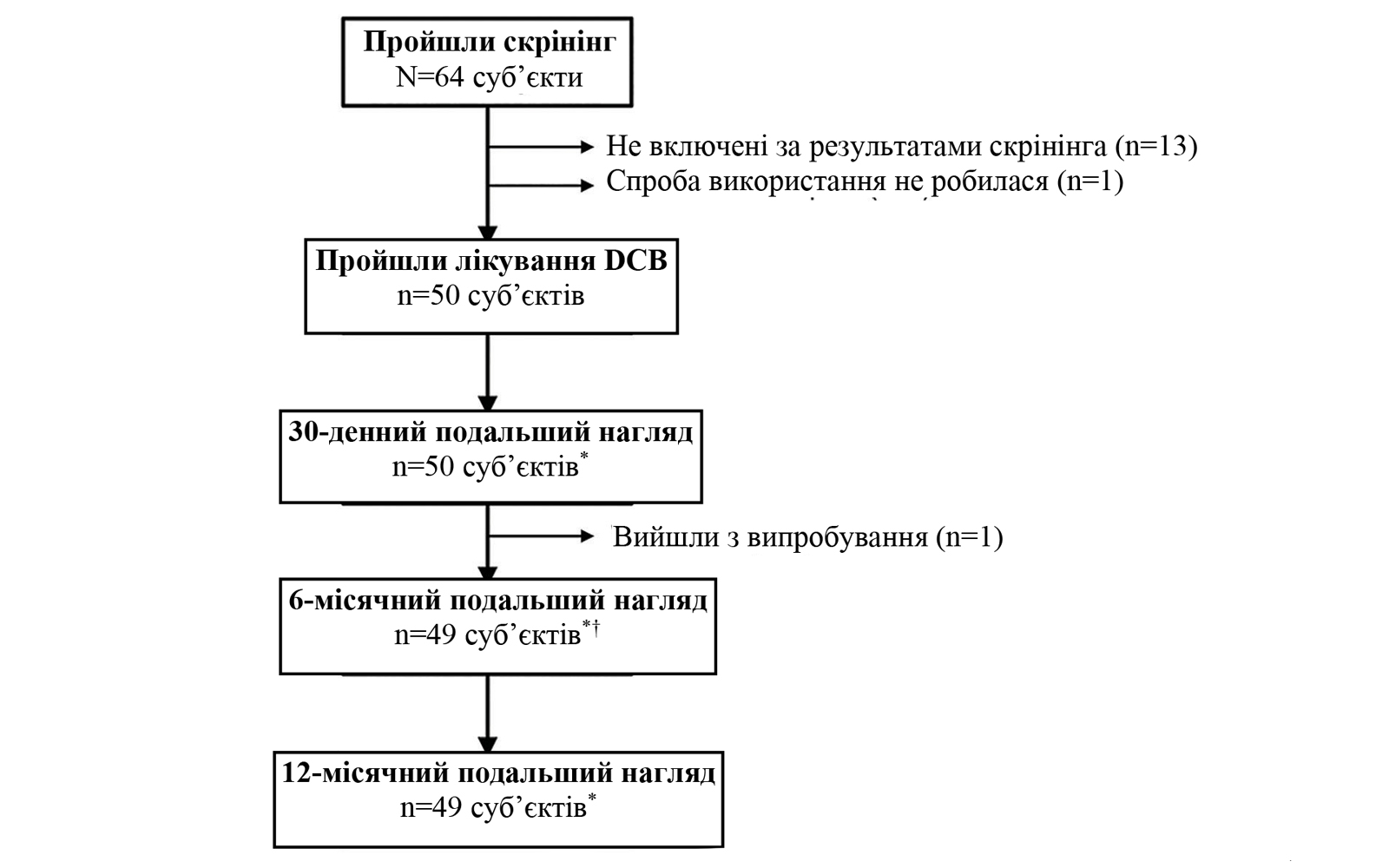
Рис. 1. Пацієнтопотік упродовж 12 місяців. * З урахуванням пацієнтів, які були живі й не вийшли з випробування до нижньої межі періоду візиту. Примітка: 1 пацієнт вийшов із випробування і мав реваскуляризацію цільового ураження через 73 дні після процедури, тому був врахований в популяції для аналізу. † Через 6 місяців 49 пацієнтів пройшли контрольну клінічну оцінку і 47 пацієнтів мали дані, що підходили для ангіографічного аналізу. DCB = балонний катетер з покриттям лікарським засобом.
Індексне втручання. Необхідною умовою була успішна предилатація за допомогою напівта/або некомплаєнтних балонних катетерів (успішність підтверджувалася даними візуальної оцінки за результатами ангіографії: резидуальний стеноз цільового ураження <30% та відсутність великої [> ступеня B] дисекції, що обмежує кровотік). Ангіографія проводилася до і після предилатації. Виконання додаткових процедур з підготовки ураження, зокрема використання ріжучих / надсікаючих балонних катетерів, атеректомії, лазера або проведення тромбектомії, не дозволялося. Хоча 23,4% уражень характеризувалися помірною або сильною кальцифікацією, випробування не проводилося на ураженнях, які неможливо було оптимальним чином підготувати до DCB з використанням некомплаєнтних балонних катетерів, оскільки такі ураження є більш складними і бракує даних на підтвердження більшої ефективності DCB у порівнянні з DES при їх лікуванні. Зважаючи на те, що клінічна оцінка цього пристрою проводилася вперше, було важливо вивчити використання DCB при ураженнях помірної складності, щоб мати змогу порівняти показники ефективності й безпеки з даними випробувань інших пристроїв. Суб’єкти з успішною предилатацією цільового ураження / цільових уражень проходили лікування з використанням пристрою Prevail DCB – балонного катетера для ЧТКА, покритого паклітакселом в цільовій дозі 3,5 мкг/мм2 та допоміжною речовиною – сечовиною. За допомогою досліджуваного пристрою можна було лікувати множинні ураження, які кожне окремо відповідали критеріям включення та виключення. Ураження, для лікування яких використовувався катетер DCB, вважалися цільовими ураженнями. Під час індексної процедури можна було провести лікування максимум чотирьох уражень (максимум трьох цільових судин). Для лікування двох уражень в одній судині не можна було використовувати DCB. Допускалося проведення лікування максимум двох судини з двома ураженнями. Для кожного ураження потрібно було використовувати окремий DCB-катетер.
Невідкладне стентування дозволялося проводити у випадках обширної дисекції та/або дисекції з обмеженням кровотоку (ступеня С чи вище) або оклюзійних ускладнень. Детальна інформація про індексну процедуру викладена в Додатку 1.
Кінцеві точки випробування. Первинною кінцевою точкою був показник пізнього зменшення просвіту (LLL) всередині стента (балона), що визначався за результатами кількісної коронарної ангіографії через 6 місяців після процедури. Якщо через 6 місяців середній показник LLL всередині стента (балона) був менше максимального допустимого рівня, що становив 0,5 мм, випробування вважалося успішним. Вторинними ангіографічними кінцевими точками, які також визначалися за допомогою кількісної коронарної ангіографії через 6 місяців після процедури, були показник LLL всередині сегмента, відсоток звуження просвіту, мінімальний діаметр просвіту (MLD) і бінарний рівень рестенозу за даними ангіографії (що визначався як стенотичне звуження просвіту ≥50%). Окрім показників LLL, усі вторинні ангіографічні кінцеві точки оцінювали всередині сегменту та стента (балона).
Вторинні клінічні результати оцінювалися через 30 днів, 6 місяців та 12 місяців після процедури в усій популяції та за типом ураження (de novo й ISR). Клінічними кінцевими точками були: усі випадки смерті; ІМ цільової судини; значне побічне серцево-судинне явище (MACE), що визначалося як комбінація смерті, ІМ (з патологічним зубцем Q і без зубця Q), невідкладного аортокоронарного шунтування або повторної реваскуляризації цільового ураження (TLR) за клінічними показаннями з використанням черезшкірних або хірургічних методів; недостатність цільової судини (TVF), що визначалася як серцева смерть, ІМ цільової судини або реваскуляризація цільової судини (TVR) за клінічними показаннями за допомогою черезшкірних чи хірургічних методів; недостатність цільового ураження (TLF), що визначалася як серцева смерть, ІМ цільової судини або TLR за клінічними показаннями за допомогою черезшкірних чи хірургічних методів; а також тромбоз стента (ураження) згідно з визначенням Консорціуму з академічних досліджень.18 Детальне визначення ІМ викладене в Додатку 1.
Була проведена оцінка нижченаведених результатів процедури: успішність використання пристрою (досягнення резидуального стенозу цільового ураження <50% з використанням тільки досліджуваного пристрою); позитивний вплив на ураження (досягнення резидуального стенозу цільового ураження <50% за допомогою будь-якого черезшкірного методу) та успішність процедури (досягнення резидуального стенозу цільового ураження <50% без госпітальних MACE).
Статистичний аналіз. Категоріальні змінні наведені у відсотках та кількісних показниках, а безперервні змінні – як середні значення ± стандартне відхилення. Статистичний аналіз виконувався з використанням пакету SAS версії 9.1 або вище («ЕсЕйЕс Інстітьют» (SAS Institute)).
Результати
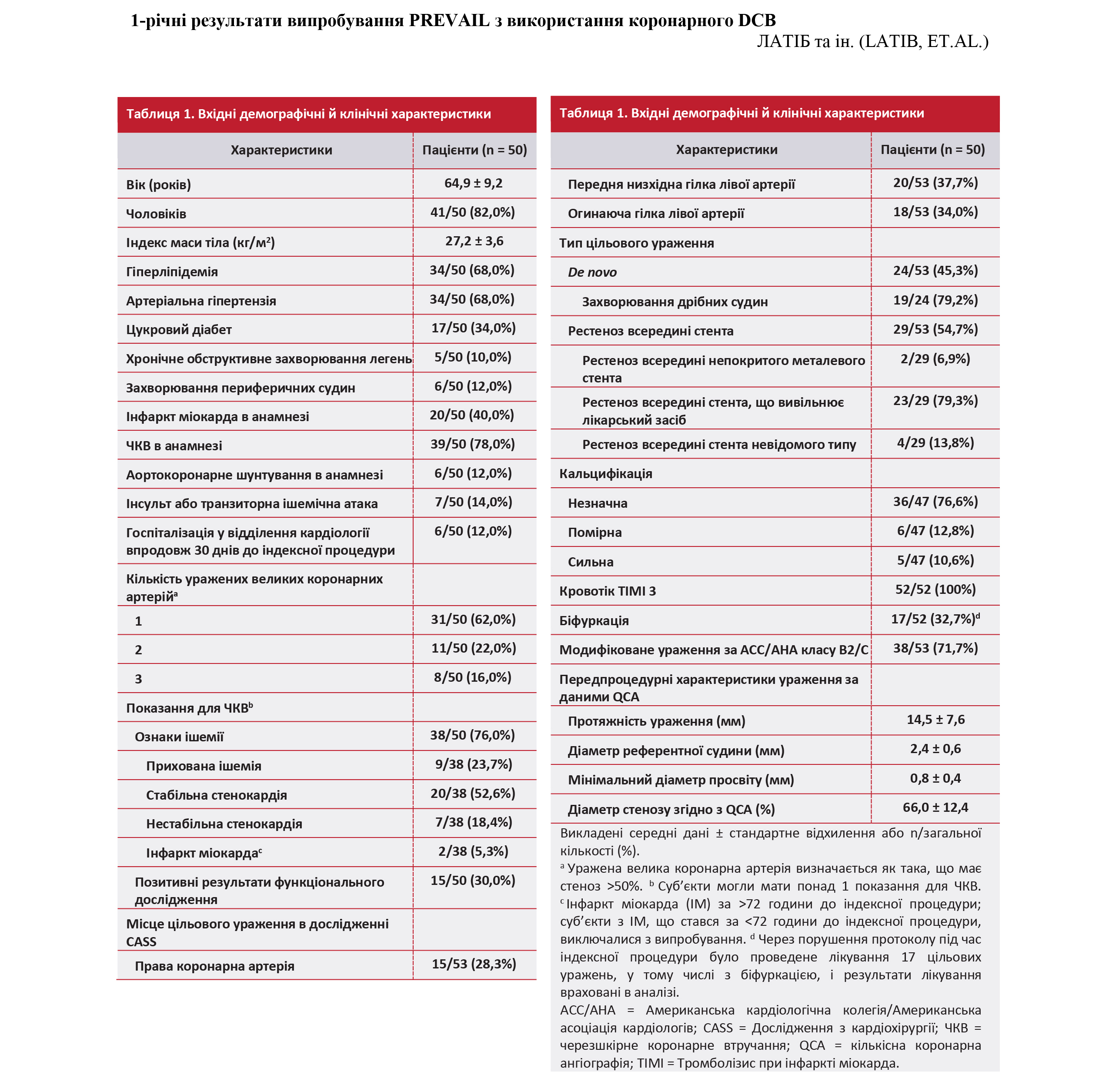
Вхідні демографічні й клінічні характеристики. Блок-схема випробування зображена на Рисунку 1. До вибірки «всі пацієнти, включені у випробування» увійшли 50 суб’єктів із 53 цільовими ураженнями. Вхідні демографічні, клінічні дані й характеристики уражень викладені у Таблиці 1. Середній вік становив 64,9 ± 9,2 роки; 82,0% учасників випробування були чоловіки. У багатьох суб’єктів спостерігалися супутні захворювання, у тому числі гіперліпідемія (68,8%), артеріальна гіпертензія (68,0%) і цукровий діабет (34,0%). Більшість пацієнтів (38/50; 76,0%) мали ознаки ішемії, при цьому стабільна стенокардія була найпоширенішим показанням для ЧКВ (20/38; 52,6%). Середня протяжність уражень становила 14,5 ± 7,6 мм, 45,3% з яких були de novo (з них 79,2% – ураження дрібних судин), а решта (54,7%) – ISR.
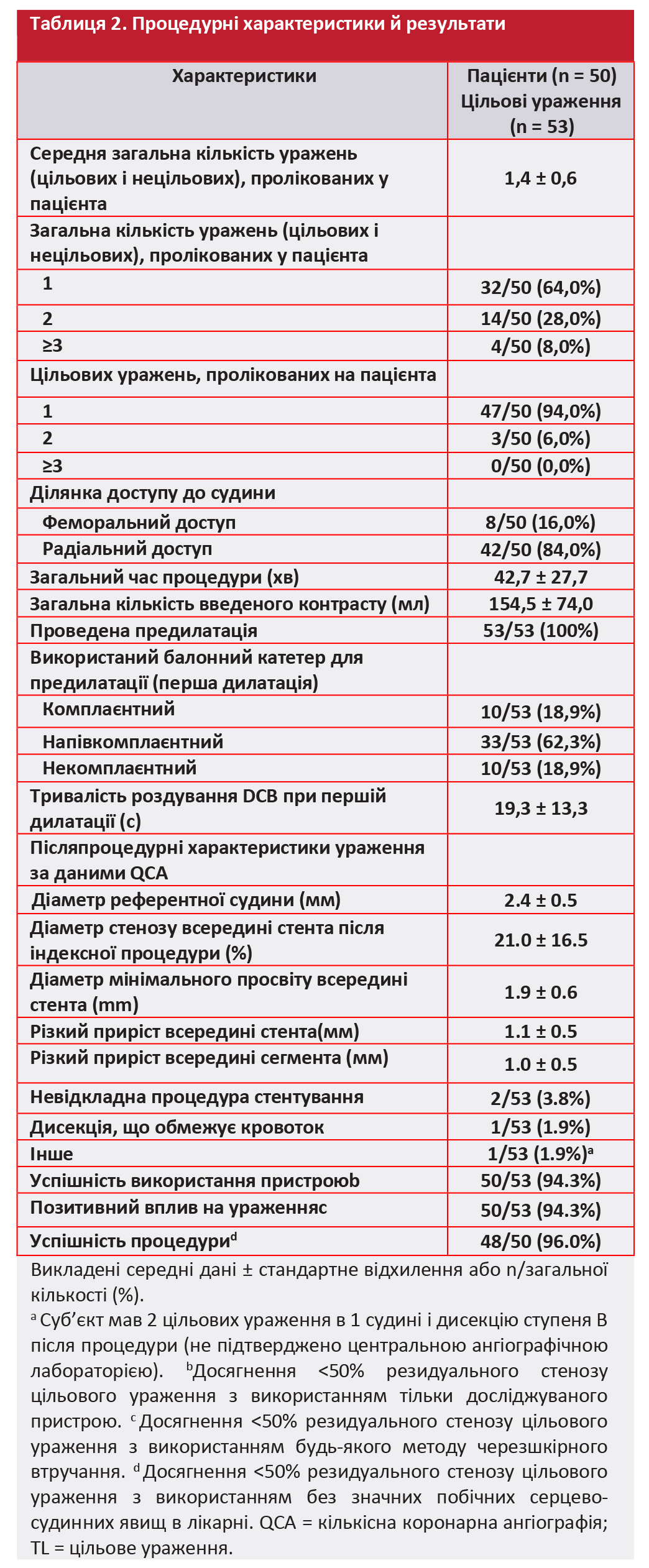
Процедурні характеристики й результати. Характеристики й результати процедури викладені у Таблиці 2. Більшості пацієнтів (94,0%) під час індексної процедури було проведене лікування 1 цільового ураження, а решті пацієнтів (6,0%) виконали лікування 2 цільових уражень. Два ураження (3,8%) вимагали невідкладної імплантації DES: 1 через дисекцію, що обмежувала кровотік, та 1 через дисекцію ступеня В без порушення дистального кровотоку. Успішність використання пристрою була досягнута для 50/53 уражень (94,3%), позитивний вплив на ураження спостерігався у 50/53 випадках (94,3%), а успішність процедури відзначалася у 48/50 пацієнтів (96,0%).
Ангіографічні результати. Випробування було успішним і характеризувалося середнім показником LLL всередині стента (балона) 0,05 ± 0,44 мм через 6 місяців після процедури, що було нижче попередньо визначеного критерію успішності – 0,50 мм. Аналіз за типом ураження продемонстрував, що середній показник LLL всередині стента (балона) через 6 місяців становив при ураженнях de novo –0,04 ± 0,41 мм і при ISR дорівнював 0,12 ± 0,45 мм. Середнє звуження просвіту внаслідок стенозу всередині стента (балона) за результатами кількісної коронарної ангіографії складало для усіх цільових уражень 23,23 ± 17,77% через 6 місяців, а рівень бінарного ангіографічного рестенозу всередині стента (балона) складав 10,0%. Ангіографічні результати узагальнені в Таблиці 3.
Клінічні результати. Упродовж 12 місяців не спостерігалося смертей, випадків ІМ або тромбозу стента (ураження) (Рисунок 2). Частота MACE через 12 місяців становила 6,0%, TVF – 10,0%, а TLR за клінічними показаннями – 6,0%. Клінічні результати за групами уражень викладені у Додатковій таблиці S2.
Обговорення
PREVAIL – проспективне багатоцентрове непорівняльне випробування використання Prevail DCB з покриттям паклітаксел для лікування уражень de novo та ISR. У випробуванні була досягнута основна кінцева точка LLL всередині стента (балона) через 6 місяців після процедури, при цьому спостерігалася низька частота клінічних явищ упродовж 12 місяців, у тому числі смертей, випадків ІМ або тромбозу стента (ураження). Частота TLR за клінічними показаннями також була низькою.
Хоча результати неможливо безпосередньо порівняти з даними, зібраними в інших дослідженнях або щодо спеціальних пристроїв, без рівноцінних зіставлень клінічні результати, одержані з використанням Prevail DCB, не поступаються даним, зареєстрованим для інших DCB з паклітакселом, через 12 місяців у подібних популяціях зі змішаним типом уражень, у тому числі коронарними ураженнями de novo, ISR і захворюванням дрібних судин. 1,5,19,20 Незважаючи на те, що загальна частота MACE у випробуванні PREVAIL упродовж 12 місяців (6,0%) була в діапазоні значень, встановлених в інших випробуваннях (5,7%-21,7%),1,5,19 випадки смерті з будь-яких причин, ІМ або тромбозу стента (ураження) не спостерігалися у випробуванні PREVAIL, отже цей показник є нижчим, ніж в будь-якому іншому дослідженні (4,9%–5,8% для смерті з будьяких причин, 1,6%–1,7% для ІМ і 0,5%–0,9% для тромбозу стента).1,19,20 MACE у випробуванні PREVAIL були зумовлені винятково TLR за клінічними показаннями (6,0%), що проводилася з частотою, яка дорівнювала нижчій межі частоти, що спостерігалася при застосуванні DCB з паклітакселом для лікування змішаних уражень (4,0%-17,8%).1,5,19,20 DCB, що використовувалися у попередніх дослідженнях, були покриті паклітакселом у концентрації 2 мкг/мм2 (Agent; «Бостон Саєнтіфік» (Boston Scientific)) або 3 мкм/мм2 (SeQuent Please, [B. Braun], IN.PACT Falcon [«Медтронік»]; Pantera Lux [«Біотронік» (Biotronik)]),1,5,19,20 що було менше, ніж концентрація, яка застосовувалася у Prevail DCB (3,5 мкг/мм2 ). Це свідчить, що збільшення дози паклітакселу не асоціювалося з погіршенням клінічних результатів упродовж 12 місяців.
Проведений нещодавно мета-аналіз результатів рандомізованих контрольованих досліджень з порівняння використання DCB та інших катетерів для лікування ISR або уражень de novo продемонстрував тенденцію до зниження смертності на тлі балонних катетерів з покриттям паклітаксел. 21 Так само в нещодавньому аналізі реєстру багатоцентрових рандомізованих відкритих досліджень, що містить дані 2289 пацієнтів із симптомним захворюванням периферичних артерій, не було виявлено відмінностей у показниках 1-річної смертності між пацієнтами, що лікувалися пристроями з покриттям паклітаксел, та пристроями без покриття лікарським засобом.22
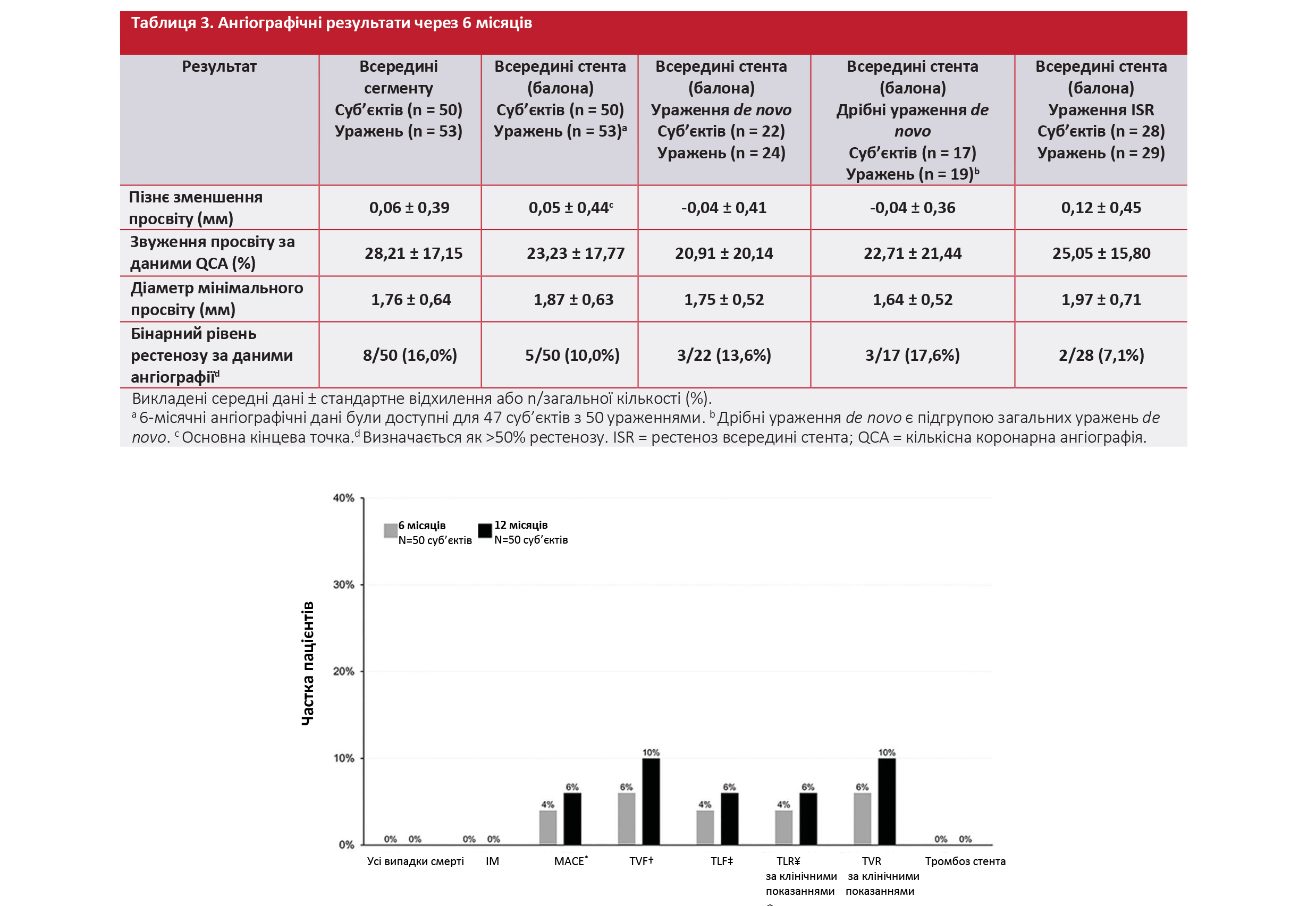
Рис. 2. Клінічні результати у загальній популяції через 6 і 12 місяців. * Визначається як смерть, інфаркт міокарда (з патологічним зубцем Q або без зубця Q), невідкладне аортокоронарне шунтування або повторна реваскуляризація цільового ураження за клінічними показаннями (TLR) черезшкірними або хірургічними методами. † Визначається як серцева смерть, інфаркт міокарда цільової судини (ІМ) або реваскуляризація цільової судини за клінічними показаннями (TVR) черезшкірними чи хірургічними методами. ‡ Визначається як серцева смерть, ІМ цільової судини або TLR за клінічними показаннями черезшкірними чи хірургічними методами. ¥ Усі отримали лікування за допомогою черезшкірного коронарного втручання. MACE = значні побічні серцево-судинні явища; TLF = недостатність цільового ураження; TVF = недостатність цільової судини.
Крім використання різних доз паклітакселу, катетери DCB відрізняються за балонною технологією, процесом покриття лікарським засобом, а також способом доставки препарату до стінок судини, що може зумовлювати відмінності в клінічних результатах. Приміром, балонні DCB-катетери IN.PACT Falcon, покриті лікарським засобом паклітаксел у дозі 3 мкг/мм2 , оцінювалися у випробуванні BELLO, в якому пацієнти були рандомізовані одержувати лікування з використанням DCB та тимчасового металевого стента або стента, що вивільнює паклітаксел. Була досягнута основна кінцева точка – LLL всередині стента (балона) (перевага P<0,01), при цьому DCB асоціювалися з частотою рестенозу й реваскуляризації, подібною до частоти при застосуванні стентів, що вивільнюють паклітаксел.16 Однак подібні результати не були досягнуті в дослідженні PICCOLETO, в якому пацієнти були рандомізовані одержувати лікування з використанням балонного катетера Dior з покриттям паклітаксел (також у дозі 3 мкг/мм2 паклітакселу; «Палекс Медікал» (Palex Medical)) або стента Taxus DES («Бостон Саєнтіфік») і яке було припинене достроково після того, як були доведені переваги DES-стентів. Сама основна кінцева точка – відсоток звуження просвіту – не була досягнута через 6 місяців, при цьому спостерігалася вища частота як відсотка звуження просвіту, так і ангіографічного рестенозу на тлі застосування балонних катетерів Dior. Незалежно від типу балонного катетера, що використовувався, оптимізація підготовки ураження та техніки застосування DCB є вкрай важливою для покращення клінічних результатів. Автор Танака (Tanaka) і колеги23 довели, що оптимальні ангіографічні результати після предилатації є передумовою одержання кращих клінічних результатів. Тому пацієнти залучалися до участі у випробуванні PREVAIL тільки після того, як хірурги змогли досягти оптимальних ангіографічних даних згідно з нещодавно опублікованими рекомендаціями Міжнародної групи з DCB. 24 Ангіографічні результати також були кращими порівняно з даними для інших DCB, зокрема SeQuent Please DCB, що нещодавно оцінювалися у рандомізованому дослідженні AGENT ISR. 25 У цьому дослідженні 6-місячний показник LLL всередині стента у пацієнтів з ISR становив 0,39 ± 0,54 мм, а в поточному – 0,12 ± 0,45 мм.
Prevail DCB, який отримав знак відповідності європейським стандартам (СЕ) у липні 2020 р., базується на технології балонних катетерів IN.PACT Falcon, SC Euphora Balloon та технології покриття лікарським засобом FreePac (усі належать «Медтронік») і має такі самі основні елементи конструкції, як Euphora, у тому числі гідрофільне покриття. Prevail DCB є вдосконаленою версією балонних катетерів першого покоління IN.PACT Falcon, при цьому очікується, що вони матимуть подібну клінічну ефективність (тобто клінічна дієвість та цільове призначення не змінюються). Prevail DCB має таке саме покриття FreePac з доведеною ефективністю, як і IN.PACT Falcon DCB, однак відрізняється за системою доставки (технологія PowerTrac), процесом нанесення покриття, цільовою дозою лікарського засобу, що використовується в балонному катетері, й розміром матриці (доступні 33 розміри). Гідрофільне покриття наноситься на дистальну частину балонного катетера в ділянці між проксимальним стиком та елементом швидкої заміни, що дозволяє оптимізувати нанесення лікувального покриття з використанням технології FreePac. У всіх DCB серії IN.PACT використовується однакова композиція для покриття FreePac, але в різних концентраціях. У Prevail DCB цільова концентрація паклітакселу в покритті становить 3,5 мкг/мм2 , а в IN.PACT Falcon – 3,0 мкг/мм2 . Ангіографічні й клінічні результати, викладені у цій статті для Prevail DCB, є аналогічними результатам, описаним в дослідженні BELLO для IN.PACT Falcon (de novo захворювання дрібних судин) 16 та окремому дослідженні ISR. 26 Незважаючи на обмеження, характерні для порівняння результатів різних досліджень, дані випробування PREVAIL узгоджуються з існуючою інформацією та підтверджують висновок, що Prevail DCB є безпечним і ефективним для лікування ішемічної хвороби серця, у тому числі випадків, пов’язаних з ураженнями, терапія яких може становити труднощі, зокрема ISR та захворювання дрібних судин. Оскільки це передринкове випробування мало невеликий розмір вибірки і у ньому не було групи порівняння, необхідно провести додаткові дослідження для підтвердження одержаних висновків. Обмежений характер дослідження. Обмежений характер випробування зумовлений типовими обмеженнями, які характерні для передринкових досліджень, у тому числі невеликим розміром вибірки та неконтрольованим дизайном без групи порівняння. Таким чином, результати цього випробування не можна безпосередньо порівнювати з даними для інших коронарних DCB за відсутності критеріїв для прямого порівняння.
Висновки У проспективному багатоцентровому неконтрольованому випробуванні за участю пацієнтів із симптомною ішемічною хворобою серця використання балонного катетера Prevail з покриттям паклітаксел для лікування коронарних уражень de novo або ISR асоціювалося зі сприятливими показниками LLL через 6 місяців і низькою частотою подій, пов’язаних з безпекою, та випадків реваскуляризації через 12 місяців. Незважаючи на потребу в проведенні подальших досліджень, результати цього передринкового випробування дають змогу висунути припущення, що балонний катетер Prevail з покриттям паклітаксел є безпечним та ефективним засобом для лікування коронарних уражень de novo й ISR. Подяки. Автори вдячні пацієнтам, що долучилися до випробування, за їх участь. Джессіка Драйс-Девлін (Jessica Dries-Devlin), PhD, CMPP, «Медтронік», та Захарі Гаррелсон (Zachary Harrelson), PhD, надали допомогу в підготовці медичного тексту згідно з правилами Належних Практик Публікації (http://www.ismpp.org/gpp3).
Література
- Basavarajaiah S, Latib A, Shannon J, et al. Drug-eluting balloon in the treatment of in-stent restenosis and diffuse coronary artery disease: real-world experience from our registry. J Interv Cardiol. 2014;27:348- 355.
- Hehrlein C, Dietz U, Kubica J, et al. Twelve-month results of a paclitaxel releasing balloon in patients presenting with in-stent restenosis first-in-man (PEPPER) trial. Cardiovasc Revasc Med. 2012;13:260-264.
- Unverdorben M, Kleber FX, Heuer H, et al. Treatment of small coronary arteries with a paclitaxel-coated balloon catheter. Clin Res Cardiol. 2010;99:165-174.
- Unverdorben M, Kleber FX, Heuer H, et al. Treatment of small coronary arteries with a paclitaxel-coated balloon catheter in the PEPCAD I study: are lesions clinically stable from 12 to 36 months? EuroIntervention. 2013;9:620-628.
- Widder JD, Cortese B, Levesque S, et al. Coronary artery treatment with a ureabased paclitaxel-coated balloon: the European-wide FALCON allcomers DCB registry (FALCON registry). EuroIntervention. 2019;15:e382- e388.
- Wöhrle J, Zadura M, Möbius-Winkler S, et al. SeQuent Please world wide registry: clinical results of SeQuent Please paclitaxel-coated balloon angioplasty in large-scale, prospective registry study. J Am Coll Cardiol. 2012;60:1733-1738.
- Baan J Jr, Claessen BE, Dijk KB, et al. A randomized comparison of paclitaxel-eluting balloon versus everolimus-eluting stent for the treatment of any in-stent restenosis: the DARE trial. JACC Cardiovasc Interv. 2018;11:275-283.
- Byrne RA, Neumann FJ, Mehilli J, et al. Paclitaxel-eluting balloons, paclitaxel-eluting stents, and balloon angioplasty in patients with restenosis after implantation of a drug-eluting stent (ISAR-DESIRE 3): a randomised, open-label trial. Lancet. 2013;381:461-467
- Jensen CJ, Richardt G, Tölg R, et al. Angiographic and clinical performance of a paclitaxel-coated balloon compared to a secondgeneration sirolimus-eluting stent in patients with in-stent restenosis: the BIOLUX randomised controlled trial. EuroIntervention. 2018;14:1096-1103.
- Pleva L, Kukla P, Kusnierova P, Zapletalova J, Hlinomaz O. Comparison of the efficacy of paclitaxel-eluting balloon catheters and everolimus-eluting stents in the treatment of coronary in-stent restenosis: the treatment of in-stent restenosis study. Circ Cardiovasc Interv. 2016;9:e003316.
- Rittger H, Brachmann J, Sinha AM, et al. A randomized, multicenter, single-blinded trial comparing paclitaxel-coated balloon angioplasty with plain balloon angioplasty in drug-eluting stent restenosis: the PEPCAD-DES study. J Am Coll Cardiol. 2012;59:1377- 1382.
- Unverdorben M, Vallbracht C, Cremers B, et al. Paclitaxel-coated balloon catheter versus paclitaxel-coated stent for the treatment of coronary in-stent restenosis. Circulation. 2009;119:2986-2994.
- Wong YTA, Kang DY, Lee JB, et al. Comparison of drug-eluting stents and drug-coated balloon for the treatment of drug-eluting coronary stent restenosis: a randomized RESTORE trial. Am Heart J. 2018;197:35-42.
- Xu B, Gao R, Wang J, et al. A prospective, multicenter, randomized trial of paclitaxel- coated balloon versus paclitaxel-eluting stent for the treatment of drug-eluting stent in-stent restenosis: results from the PEPCAD China ISR trial. JACC Cardiovasc Interv. 2014;7:204-211.
- Jeger RV, Farah A, Ohlow MA, et al. Drug-coated balloons for small coronary artery disease (BASKET-SMALL 2): an open-label randomised non-inferiority trial. Lancet. 2018;392:849-856.
- Latib A, Colombo A, Castriota F, et al. A randomized multicenter study comparing a paclitaxel drug-eluting balloon with a paclitaxeleluting stent in small coronary vessels: the BELLO (balloon elution and late loss optimization) study. J Am Coll Cardiol. 2012;60:2473-2480.
- Tang Y, Qiao S, Su X, et al. Drug-coated balloon versus drug-eluting stent for small-vessel disease: the RESTORE SVD China randomized trial. JACC Cardiovas Interv. 2018;11:2381-2392.
- Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007;115:2344-2351.
- Toelg R, Merkely B, Erglis A, et al. Coronary artery treatment with paclitaxel-coated balloon using a BTHC excipient: clinical results of the international real-world DELUX registry. EuroIntervention. 2014;10:591-599.
- Uhlemann M, Möbius-Winkler S, Adam J, et al. The Leipzig prospective drug-eluting balloon-registry — outcome of 484 consecutive patients treated for coronary in-stent restenosis and de novo lesions using paclitaxel-coated balloons. Circ J. 2016;80:379-386.
- Scheller B, Vukadinovic D, Jeger R, et al. Survival after coronary revascularization with paclitaxel-coated balloons. J Am Coll Cardiol. 2020;75:1017-1028.
- Nordanstig J, James S, Andersson M, et al. Mortality with paclitaxelcoated devices in peripheral artery disease. N Engl J Med. 2020;383:2538- 2546.
- Tanaka A, Latib A, Jabbour RJ, et al. Impact of angiographic result after predilatation on outcome after drug-coated balloon treatment of in-stent coronary restenosis. Am J Cardiol. 2016;118:1460-1465.
- Jeger RV, Eccleshall S, Wan Ahmad WA, et al. Drug-coated balloons for coronary artery disease: third report of the International DCB Consensus Group. JACC Cardiovasc Interv. 2020;13:1391-1402. Epub 2020 May 27.
- Hamm CW, Dorr O, Woehrle J, et al. A multicentre, randomised controlled clinical study of drug-coated balloons for the treatment of coronary in-stent restenosis. EuroIntervention. 2020;16:e328-e334.
- Basavarajaiah S, Naganuma T, Latib A, et al. Treatment of drug-eluting stent restenosis: comparison between drug-eluting balloon versus second-generation drug-eluting stents from a retrospective observational study. Catheter Cardiovasc Interv. 2016;88:522-528.